亘喜生物:学术盛会登台汇报、海外临床继续突破
近日,亘喜生物在ASH 2023年会上以口头报告方式汇报了BCMA/CD19 FasTCAR-T疗法GC012F一线治疗高危多发性骨髓瘤新确诊患者(NDMM)的一期最新数据。

截至2023年10月1日,22例可评估患者中位随访时间18.8个月,疗效方面:ORR依旧高达100%,sCR率也高达95.5%,MRD- 率同样保持了100%,中位DOR和中位PFS数据尚未成熟。
安全性方面,GC012F延续了一贯的卓越表现。仅27%(6/22)的患者出现细胞因子释放综合征(CRS),且均为低级别,包括1级(23%,5/22)和2级(5%,1/22)。未观察到患者出现任何级别的ICANS或其他神经毒性。
NDMM是亘喜生物基于GC012F的安全性优势,在多发性骨髓瘤领域前瞻性布局的一条赛道。早在去年ASH年会,公司就首次公布了这项IIT 研究的临床数据,安全性和疗效都非常好;今年9月的IMS年会上,又做过数据更新,此次能继续入选ASH 2023口头报告,不难看出业界对于GC012F针对NDMM一线治疗抱以厚望。
GC012F的优异安全性,为其拓展更广的治疗领域奠定了坚实基础。上月,亘喜还曾宣布GC012F治疗难治性系统性红斑狼疮的1/2期临床试验申请获得FDA批准。
不同于肿瘤的治疗,自身免疫性病作为一种慢性、不会迅速危及生命的疾病,监管机构对于其治疗的安全性要求更高。
作为国内第一批开展探索CAR-T在自身免疫性疾病领域的CGT企业,亘喜在今年5月就宣布启动GC012F治疗rSLE的IIT研究;11月,公司披露了4例患者的早期转化样本结果:治疗后B细胞表型恢复到初始表型,初步证明了该疗法能有效实现免疫重置。
鉴于目前已有几家公司开展了靶向CD19的CAR-T治疗SLE的研究,公司披露的另一项ELISPOT试验也在积极证明:与CD19单靶点CAR-T疗法相比,GC012F的CD19/BCMA双靶点设计,能更高效地清除产生自身抗体的B细胞和浆细胞。预计到2024年,可以看到更多相关数据。
优异的疗效与安全性,意味着GC012F正在血液肿瘤和自免领域不断解锁更大的获益潜力。
如今,亘喜生物已经搭建起了一条独具特色的产品管线,除了GC012F外,还有针对实体瘤的Claudin18.2 CAR-T,以及通用CAR-T疗法。核心技术平台FasTCAR旨在全面提升传统CAR-T的疗效、安全性以及可及性。基于该技术,亘喜能将传统CAR-T的生产时间从几周缩短到次日完成,更快惠及患者的同时,也能显著降低人员及设备工时的成本,这对于后续降低定价,提升CAR-T可及性,意义重大;另一方面,CAR-T细胞干性的增强显著改善了CAR-T的持久性,同时可以用更低的剂量达到更好的治疗效果。也是因为如此,提高疗效的同时也显著地改善了安全性。
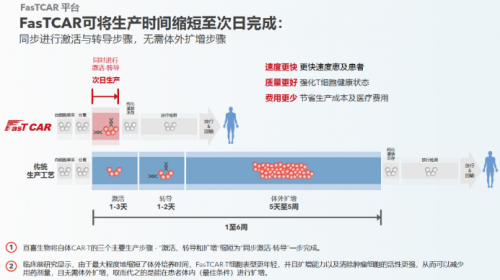
GC012F正是基于FasTCAR技术平台开发的核心产品,同时通过BCMA/CD19双靶点的结合,可以覆盖更多患者,并减少了逃逸复发风险。目前,GC012F在各项临床研究中已经治疗了60例患者,适应症涵盖RRMM、NDMM、B-NHL以及rSLE。随着后续其各适应症管线的临床数据不断更新,我们可以期待更多的临床证据将支持其差异化的疗效与安全性优势。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
责任编辑:kj005
文章投诉热线:182 3641 3660 投诉邮箱:7983347 16@qq.com










