罗欣药业:收到《药物临床试验批准通知书》 P-CAB注射剂即将启动临床
6月30日下午,罗欣药业(002793.SZ)公告,其下属子公司山东罗欣药业集团股份有限公司、罗欣药业(上海)有限公司收到国家药品监督管理局下发的注射用LX22001的《药物临床试验批准通知书》。
注射用LX22001即公司创新药替戈拉生的注射剂型,是钾离子竞争性酸阻滞剂类药物(P-CAB),目前在全球范围内尚无产品上市。罗欣药业表示,本次注射用LX22001临床试验获得批准,体现了公司在巩固核心领域优势的基础上持续发力,彰显了公司科技创新能力,有助于丰富产品管线,提升公司创新药优势领域核心竞争力。
查阅相关资料了解到,作为全新机制的P-CAB相比于传统质子泵抑制剂(PPI),具有更快速起效、更强效持久抑酸、服用更方便等特点,首剂即可达到更大抑酸效果,有效抑制夜间酸突破等优势。目前,最新的中国消化领域疾病指南已将P-CAB口服剂型作为反流性食管炎的首选药物之一。此次获准临床的注射用LX22001开发适应症为:(1)本品可作为当口服疗法不适用时,用于下列病症的替代疗法:反流性食管炎、十二指肠溃疡;(2)消化性溃疡出血。注射剂型的临床应用场景与口服剂型存在差异,更多应用于手术、住院等。
2023年中国抑酸市场Value IQVIA数据显示,注射剂+口服剂市场在经历国家集采、重点监控目录及医保PPI针剂加限等政策调控后仍有超200亿市场规模,其中注射剂占55%的市场份额。罗欣药业作为上一代PPI注射剂的销售王者,布局P-CAB注射剂型将有利于巩固其消化领域市场地位,为公司消化类产品业绩提升带来更大想象空间。
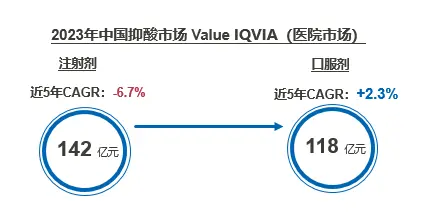
随着P-CAB被越来越多的专家、患者认可,未来有望成为主流抑酸药物逐渐替代PPIs。
近年来,罗欣药业持续深化创新转型,聚焦医药工业提升消化领域核心优势,已取得多项突破。2022年4月,公司首款1类新药替戈拉生片“反流性食管炎”适应症获批上市。2023年11月,替戈拉生片新增“十二指肠溃疡”适应症获批上市。2023年12月,替戈拉生片新适应症“与适当的抗菌疗法联用根除幽门螺杆菌”上市申请获得国家药品监督管理局受理,该适应症的临床数据根除率优效于对照组艾司奥美拉唑,为该适应症首个根除率超90%的P-CAB。
2024年1月,公司消化领域布局的另一款新药普卡那肽片的Ⅲ期临床试验已完成,达成主要疗效终点,有望成为国内首个治疗慢性特发性便秘的鸟苷酸环化酶激动剂。中国受便秘困扰的成人达到9870万人-2.86亿人。随着生活节奏加快、饮食结构改变、人口老龄化及社会心理因素的影响,便秘患病率呈上升趋势。IQVIA数据显示,同类促泌剂产品2023年美国销售金额超28亿美金。
值得一提的是,罗欣药业还积极拓展消化领域产品布局,今年达成合作的创新医疗技术有望为公司贡献新的业绩增量。2024年6月,罗欣药业与国际领先的AI+BT微生态研发企业深圳未知君就肠道菌群移植技术(FMT)在合作区域内合作范围的独家代理经销合作达成一致意见。根据协议约定,公司采购该项目业绩指标第一年为1500万元,第三年为5000万元,第五年即达到2亿元,复合增长率91.09%。
作为一种新兴的治疗方法,FMT受到了国内外的广泛关注。越来越多的证据表明FMT可用于治疗多种菌群失调相关性疾病,且应用安全、范围广泛、潜力巨大。国际登记在册的FMT临床试验达489个,在治疗艰难梭菌感染(CDI)方面FMT已表现出显著效果,此外,FMT在治疗自闭症、炎症性肠病(IBD)、肠易激综合征(IBS)、代谢性疾病、自身免疫疾病等方面也具有较大潜力。
与此同时,国内对FMT的政策支持及专家共识也在不断提升。2022年《肠道菌群移植临床应用管理中国专家共识》发布,2023年9月,FMT肠道菌群移植正式被纳入卫健委、中医药局、疾控局三部门联合印发的《全国医疗服务项目技术规范(2023年版)》,风险等级为10低于胃镜检查29.7的风险等级,安全性极佳。截至目前,已有18个省份拥有该技术医疗收费条码,商业化可及性提升。某业内人士在接受采访时表示,罗欣药业作为消化道领域龙头在商业化方面极具优势,加上深圳未知君在FMT领域研发的领先地位,二者合作可谓强强联合,作为各自领域引领者共同挖掘国内蓝海市场。
不难发现,近年来罗欣药业不断布局丰富消化领域创新产品组合,结合其商业化优势及已获批产品的临床研究经验创新升级,相信公司消化领域龙头地位将持续巩固。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
责任编辑:kj005
文章投诉热线:182 3641 3660 投诉邮箱:7983347 16@qq.com











