CELL子刊 | 喝奶茶抗癌?上海交大:多组学联合揭示“颠覆性认知”!果糖抑制肿瘤生长

果葡糖浆主要由玉米淀粉水解制得,是奶茶,果茶等流行饮品中的主要添加糖,因其“便宜、好用”的高性价比打开了食品行业使用果葡糖浆的新局面。当果葡糖浆中有超过一半的成分是果糖,使用果葡糖浆的饮品就会具备水果的香甜和清凉感,而且其甜度会爆发在饮品入口的前段,增加饮品的整体风味。越来越多的果糖摄入开始让人们认识到,果糖摄入的增加与肥胖,通风,糖尿病的发病率相关。

也有越来越多的证据表明,果糖消费与癌症发病率之间存在关联。摄入高果糖会增强小鼠肝脏和结肠直肠肿瘤的发生。相反,在美国国立卫生研究院-美国退休人员协会(NIH-AARP)的饮食与健康研究中,果糖对肺癌有保护作用。这相悖的结论不仅让人生疑,果糖到底防癌还是致癌?
近日,Cell Metabolism在线发表了上海交通大学医学院邹强研究员团队与叶幼琼团队等多个课题组合作题为“Dietary fructose-mediated adipocyte metabolism drives antitumor CD8+ T cell responses”的研究成果。在这项研究中,作者发现高果糖饮食喂养小鼠可改善 CD8+ T 细胞的抗肿瘤反应并延缓肿瘤生长,诱导脂肪细胞产生依赖于 mTORC1 的瘦素,并提高血清和肿瘤组织中的瘦素水平,高血浆瘦素水平与肺癌患者抗肿瘤 T 细胞活性的增强相关。实验表明,膳食果糖在引导脂肪细胞代谢以形成 CD8+ T 细胞免疫反应和控制肿瘤生长方面具有重要作用。
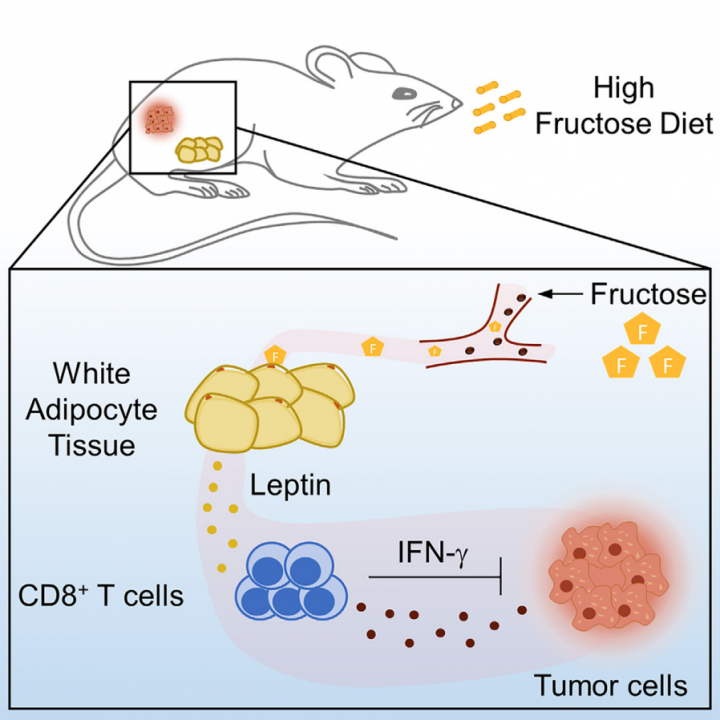
研究结果
1.膳食果糖促进体内抗肿瘤T细胞免疫反应
为了研究膳食果糖对体内抗肿瘤免疫反应中的影响,作者用高果糖膳食或正常膳食喂养 小鼠,喂养 14 天后用黑色素瘤细胞攻击小鼠,致使小鼠成瘤。结果显示,高果糖能显著抑制小鼠肿瘤生长和肿瘤诱导的致死率(图 1A 和 1B)。对肺癌小鼠和结肠癌小鼠喂食高果糖能缩小肿瘤体积并提高存活率(图 1C、1D)。
鉴于T 细胞是 TME 中抗肿瘤免疫反应的主要介质,所以作者利用单细胞转录组技术,对 B16-F10 肿瘤小鼠肿瘤组织中分离出的 CD3+ CD45+ T 细胞进行了单细胞 RNA 测序。通过无监督模型,将T细胞分为8簇,其中在代表 CD8+ T 细胞的三个细胞群中,高果糖饮食小鼠肿瘤中的 CD8+ Tex 细胞减少,CD8+ Tmem 细胞大幅增加(图 1G),说明果糖可能会影响瘤内 CD8+ T 细胞亚群的分化。
为了评估CD8+ T 细胞是否参与果糖介导的抗肿瘤活性,作者对缺乏成熟T细胞的 Rag1 基因敲除(KO)的成瘤小鼠喂食高果糖,肿瘤生长无差异;但消耗CD8+ T 细胞小鼠喂食高果糖,恢复肿瘤生长。这些结果表明,高果糖喂养小鼠可增加 CD8+ T 细胞免疫反应并控制肿瘤进展。
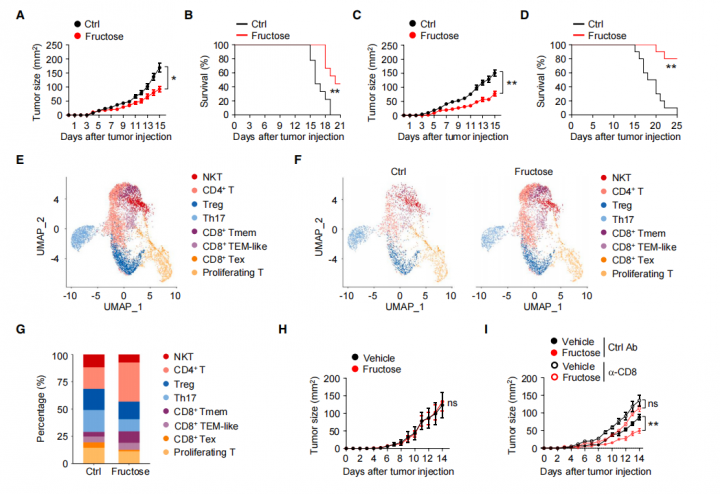
图1 单细胞转录组数据及实验数据揭示膳食果糖促进体内抗肿瘤T细胞免疫反应
2.肿瘤浸润CD8+ T细胞的转录组分析
接下来作者通过单细胞转录组的拟时序分析探究肿瘤浸润 CD8+ T 细胞的动态免疫状态和细胞转换。分析显示,Tmem 细胞位于轨迹路径的起点,而终末衰竭的 CD8+ Tex 细胞和终末分化的效应细胞(terminal Teff)CD8+ T 细胞则处于终末状态(图 2C)。高果糖饮食喂养的小鼠的肿瘤中,主要分布早期阶段的 CD8+ T 细胞,对照组小鼠肿瘤中的 CD8+ T 细胞主要分布在衰竭状态的末端(图 2D)。表明喂食果糖介导的 CD8+ T 细胞向终末衰竭的过渡减弱,膳食果糖调节了肿瘤浸润CD8+ T细胞的转录状态和转归,从而产生了卓越的抗肿瘤效果。
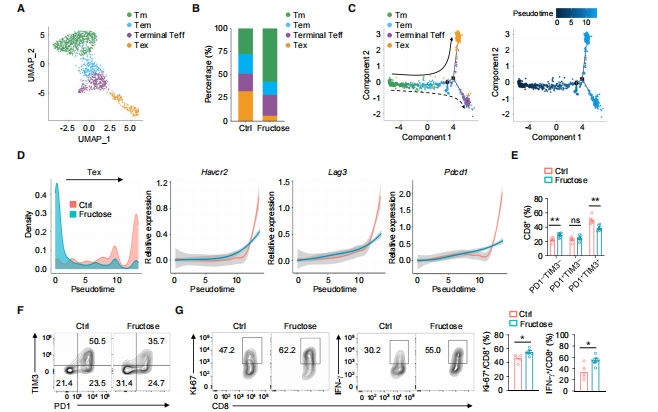
图2 肿瘤浸润性CD8+ T细胞的转录组分析
3.膳食果糖通过瘦素增强抗肿瘤T细胞反应
作者假设饮食中的果糖会诱导免疫激活因子的释放,从而促进抗肿瘤 T 细胞反应的增强。作者分析了果糖饮食小鼠血清中的 32 种免疫因子,在这些检测到的免疫因子中,发现脂肪因子瘦素在高果糖饮食喂养的小鼠血清中上调(图 3A 和 3B),瘦素可增加 TME 中的 T 细胞效应功能。
为了确定瘦素是否是否对果糖增强的抗肿瘤 T 细胞反应至关重要的问题,作者用抗瘦素单克隆抗体(mAb)处理肿瘤小鼠,中和瘦素加速了肿瘤生长,促进了肿瘤诱导的致死率,并降低了高果糖饮食小鼠的肿瘤浸润细胞的频率(图 3E、3F)。在携带瘦素受体缺陷T细胞并以高果糖饮食喂养的肿瘤小鼠中,肿瘤体积增大,肿瘤浸润Ki-67+和IFN-g+ CD8+ T细胞的频率降低(图3G-3I)。因此,膳食果糖可通过增强瘦素信号增强抗肿瘤T细胞反应。

图3.膳食果糖通过瘦素增强抗肿瘤T细胞反应
4.膳食果糖启动脂肪细胞来源的瘦素生成
瘦素是一种重要的脂肪因子,主要产生于白色脂肪组织。通过分析之前发表的小鼠白色脂肪组织的单细胞转录组数据分析,作者发现白色脂肪组织脂肪细胞中的瘦素基因表现出特异性富集(图 4A)。作者获得Slc2a5脂肪细胞敲除系,发现喂食高果糖的敲除系,小鼠肿瘤体积显著增大(图4E)。Slc2a5编码基因GLUT5 缺乏会降低高果糖饮食喂养小鼠脂肪细胞中瘦素的表达(图 4C)。这些结果表明,膳食果糖能启动脂肪细胞源性瘦素的产生,从而增强 CD8+ T 细胞的抗肿瘤功能。
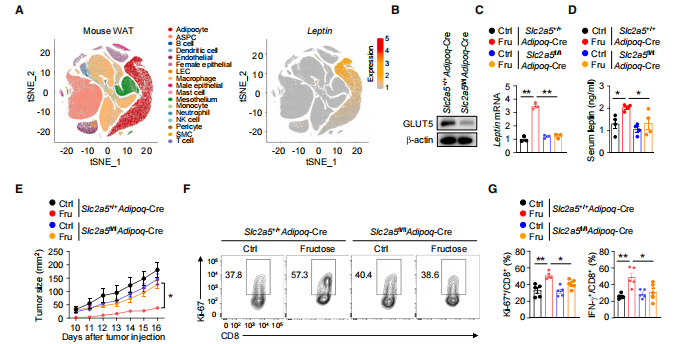
图4 饮食中的果糖启动脂肪细胞衍生的瘦素的产生
5.白色脂肪细胞的转录组与代谢组分析
那么果糖代谢是如何调控脂肪细胞中瘦素的表达?作者对高果糖饮食小鼠和正常小鼠的白色脂肪组织进行了转录组和代谢组的检测。代谢组显示,高果糖饮食小鼠脂肪中的糖酵解中间产物,如磷酸二羟丙酮(DHAP)、乳酸和丙酮酸(PA)的水平显著增加(图 5C)。转录组分析发现,高果糖饮食激活了脂肪中的mTORC1 信号通路(图 5D 和 5E)。作者先前的数据发现,mTORC1 复合物中的一个关键成分 Raptor 的缺失会影响脂肪细胞中 瘦素 的表达。为了验证mTORC1 信号在脂肪细胞源性瘦素表达中的作用,作者获得了Raptor基因敲除小鼠,发现Raptor 缺乏会降低脂肪细胞中瘦素的表达,高果糖饮食小鼠血清瘦素水平明显下降(图 5H 和 5I),加速肿瘤生长(图 5J 和 5K)。这些结果表明,果糖诱导脂肪细胞产生瘦素依赖于 mTORC1 的激活。
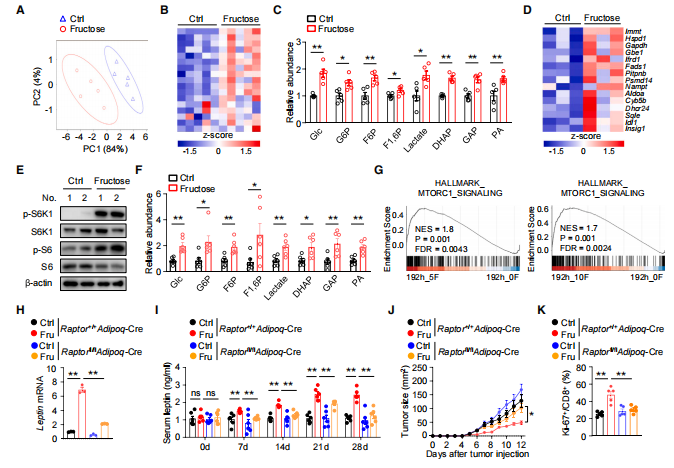
图5 转录组与代谢组揭示果糖启动的瘦素产生依赖于mTORC1的激活
6.肺癌患者血浆瘦素水平升高与T细胞反应增强相关
最后作者分析了果糖-瘦素轴在癌症患者中的临床意义。肺癌患者中,浆中果糖和瘦素浓度呈正相关(图 6A 和 6B)。但是结直肠癌患者中,血浆瘦素浓度与血浆果糖浓度或肿瘤浸润 IFN-g+ 效应 CD8+ T 细胞的百分比无关(图 6E 和 6F),饲喂高果糖饮食抑制了LLC原位肿瘤的生长,并增加了肿瘤浸润Ki- 67+和IFN-g+ CD8+T细胞的频率。表明饮食果糖介导的抗肿瘤T细胞免疫反应受肿瘤注射部位的影响。总之,这些结果表明,血浆瘦素水平的升高与肺癌患者T细胞反应的增强有关,喂食果糖可促进LLC原位肺癌模型中的抗肿瘤T细胞免疫反应。

图6.肺癌患者血浆瘦素水平升高与T细胞反应增强相关
研究结论
作者发现膳食果糖能调节脂肪细胞的新陈代谢,从而增强 CD8+ T 细胞的抗肿瘤免疫反应并控制肿瘤生长。肿瘤浸润 CD8+ T 细胞的转录组数据分析显示,膳食果糖介导 CD8+ T 细胞向终末衰竭的过渡减弱,从而产生卓越的抗肿瘤疗效。 高果糖喂养以一种依赖于 mTORC1 的方式启动了脂肪细胞来源的瘦素分泌,从而引发了瘦素增强的抗肿瘤 CD8+ T 细胞反应。 重要的是,高血浆瘦素水平与血浆果糖浓度升高和肺癌患者抗肿瘤 CD8+ T 细胞反应改善相关。研究描述了膳食果糖在塑造脂肪细胞代谢以增强抗肿瘤 CD8+ T 细胞反应中的关键作用,并强调了果糖-瘦素轴可被用于癌症免疫疗法。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
责任编辑:kj005
文章投诉热线:182 3641 3660 投诉邮箱:7983347 16@qq.com










