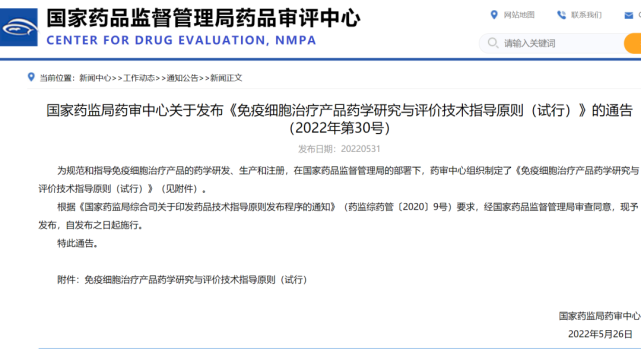
积极响应国家药监局《免疫细胞治疗产品药学研究与评价技术指导原则》,汉氏联合以实际行动促经济发展
2022年5月31日,国家药品监督管理局在《免疫细胞治疗产品药学研究与评价技术指导原则》“征求意见(2020.09.30)”的基础上发布“试行”版本,经国家药品监督管理局审查同意,并于发布之日起施行。
基于《指导原则》,根据国家药监局政策指导,北京汉氏免疫细胞存储业务已经开始普惠国民。北京汉氏联合生物技术有限公司作为生物科技行业先行者,在韩忠朝院士的带领下,在细胞领域的研究有目共睹。早在2012年韩忠朝院士团队在《Stem Cells International》杂志上发表综述“Safety of Mesenchymal Stem Cells for Clinical Application”,表明脐带间充质干细胞没有成瘤的风险,并且间充质干细胞在裸鼠等动物上应用无致敏性和没有明显毒性。
根据《中华人民共和国药品管理法》第二条关干药品的定义:本法所称药品,是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质包括中药、化学药和生物制品等。药品直接关系到人们的身体健康甚至生命存亡。因此,其质量不得有半点马虎,必须确保药品的安全、有效、均一、稳定。
鉴干特殊干细胞及其衍生物是一种全新的生物制品,其生产过程的质量把控,包括纯度、稳定性和效能的检测、研究人员的技术操作等,直接关系到试验的风险和受试者的安全:与化药相比,具有活性的细胞制品要保证其均一稳定性,则需要更全面监测手段,更严谨的工作流程,以及更稳妥的物流运输做保障。

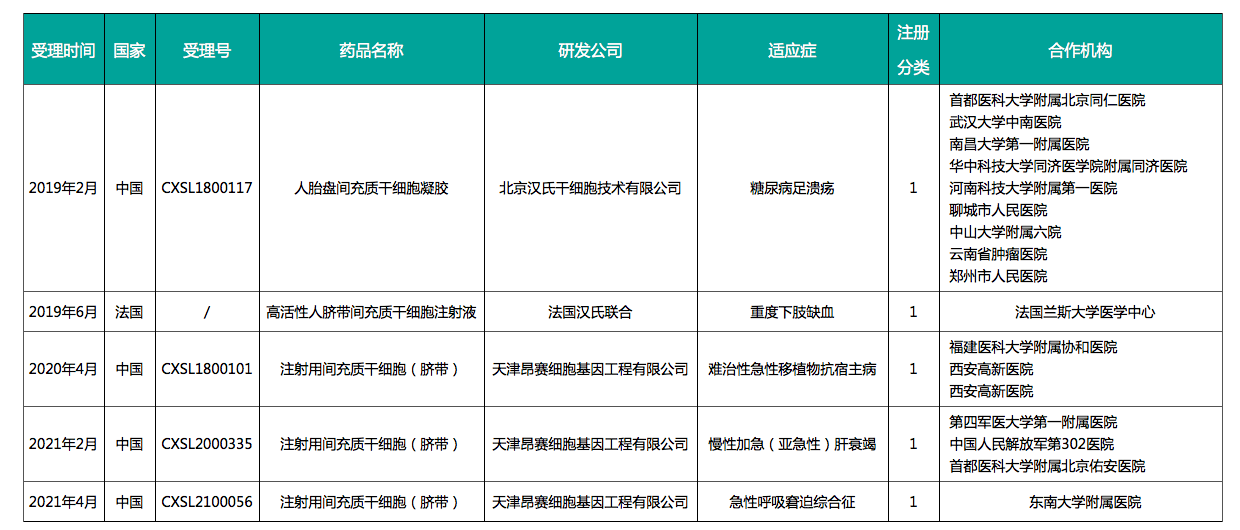
2021年4月21日,汉氏联合集团旗下子公司天津昂赛细胞基因工程有限公司提报的干细胞1类新药:注射用间充质干细胞(脐带)的新药临床试验申请获得国家药监局药品审评中心(CDE)默示许可(CXSL2100056)。自此,汉氏联合集团共有6个干细胞新药临床试验获批,其中一个新药“高活性人脐带间充质干细胞注射液”I/IIa期临床试验获得法国药监局(ANSM)签发许可,用于治疗“重度下肢缺血”。汉氏联合6个新药IND获批,国内一路领先。
《指导原则》明确指出适用范围:免疫细胞治疗产品是指源自人体细胞或人源细胞系的细胞,经过体外操作,包括但不限于分离、纯化、培养、扩增、诱导分化、活化、遗传修饰、细胞库(系)的建立、冻存复苏等,再输入或植入到患者体内,通过诱导、增强或抑制机体的免疫功能而治疗疾病的免疫细胞治疗产品,例如CAR-T、DC等。
体细胞,如胰岛细胞、软骨细胞等,以及细胞与非细胞成分的组合产品的细胞部分也可以参考本指导原则。细胞衍生产品,如细胞外泌体、细胞裂解物、灭活细胞等产品,其细胞部分的药学研究也可能适用。经基因修饰的免疫细胞治疗产品,如 CAR-T等,其细胞部分可以参考本指导原则,基因修饰部分可以参考其他相关技术指南。本指导原则适用于按照药品管理相关法规进行研发和注册申报的免疫细胞治疗产品,主要适用于上市申请阶段的药学研究。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
责任编辑:kj005
文章投诉热线:156 0057 2229 投诉邮箱:29132 36@qq.com