iPSC 定向分化类器官:重塑疾病研究与治疗的前沿格局
在再生医学与疾病研究的浪潮中,诱导多能干细胞(iPSC)技术正以颠覆性力量改写行业规则。其核心魔力在于将成熟体细胞重新编程为具备全能分化潜能的多能干细胞,通过精准诱导分化,可定向培育出形态与功能高度模拟人体真实器官的微型三维组织模型——类器官。从糖尿病到帕金森病,从肝脏疾病到心血管疾病,这些 “迷你器官” 正突破传统研究瓶颈,为疾病机制解析、个性化治疗方案开发提供全新工具,成为生物医学领域的璀璨新星。
↑ 诱导多能干细胞(iPSC)的形态
一、hiPSC源胰岛类器官:糖尿病治疗的革命性突破
糖尿病是一种全球性高发的慢性代谢性疾病,其核心问题是胰岛β细胞功能受损,导致胰岛素分泌不足。hiPSC源胰岛类器官的出现为糖尿病研究和治疗带来了新的希望。通过特定的生长因子和信号分子,hiPSC能够被诱导分化为胰岛β细胞,并进一步构建为胰岛类器官。
这些类器官不仅在形态上高度模拟真实胰岛,还能在体外响应血糖变化,自动调节胰岛素分泌,从而维持血糖稳定。在动物模型中,hiPSC源胰岛类器官已经展现出显著的血糖调节能力,为未来的细胞替代疗法提供了有力支持。此外,结合基因编辑技术,科学家们能够在体纠正导致糖尿病的基因突变,实现个性化的β细胞再生。这种从根源上解决问题的方法,有望彻底改变糖尿病的治疗格局。
盛合瑞生物的iPSC类器官分化平台为hiPSC源胰岛类器官的培养提供强力支撑,配合分步诱导方案,通过葡萄糖刺激实验明确了hiPSC源胰岛类器官的胰岛素分泌功能。此外,单细胞测序结果明确了盛合瑞生物构建的hiPSC源胰岛类器官的细胞组成。通过免疫荧光染色检测β细胞与α细胞分布等多维度验证,确保hiPSC源胰岛类器官的功能完整性。结合类器官基因编辑技术,移植后有望在体内纠正糖尿病相关基因突变,实现个性化β细胞再生,为糖尿病患者带来治愈的希望。
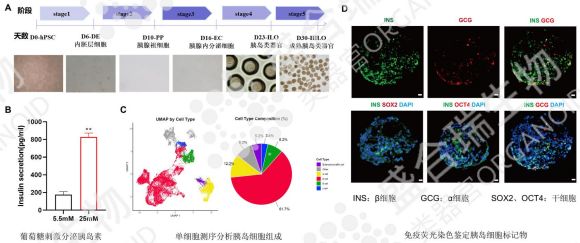
↑ 盛合瑞生物构建的hiPSC源胰岛类器官
二、hiPSC源肝类器官:肝脏疾病研究的全能工具
肝脏是人体内最重要的代谢器官之一,负责解毒、合成蛋白质和调节代谢等多种功能。hiPSC源肝类器官的出现为肝脏疾病的研究和治疗提供了新的工具。通过精确的诱导分化,hiPSC能够被分化为肝细胞,并构建为具有功能的肝类器官。这些类器官能够高度模拟肝脏的微环境,展现出与真实肝脏相似的代谢功能。
在疾病模型构建方面,hiPSC源肝类器官能够用于模拟多种肝脏疾病,如肝炎、肝硬化和肝癌。通过高通量药物筛选,这些类器官能够快速评估新药的疗效和安全性,为肝脏疾病的治疗提供新的思路。此外,hiPSC源肝类器官还能够用于患者特异性的细胞替代疗法,避免免疫排斥反应。这种个性化治疗方案不仅提高了治疗的安全性和有效性,还为肝脏再生医学提供了新的方向。
盛合瑞生物已成功构建hiPSC源肝类器官,通过HE及免疫荧光染色鉴定了肝类器官的细胞组成,结合培养上清中白蛋白、α1-抗胰蛋白酶、胆汁酸分泌水平及细胞色素P450 3A4活性检测,全面确保盛合瑞生物构建的hiPSC源肝类器官的成熟度与功能完整性。该类器官模型可广泛应用于肝炎、肝硬化、肝癌等疾病模型构建,通过高通量药物筛选快速评估新药疗效与安全性,同时为患者特异性细胞替代疗法提供可能,有效避免免疫排斥反应,为肝脏再生医学开辟全新路径。
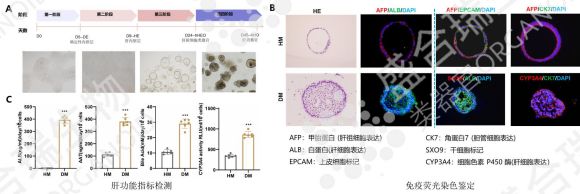
↑ 盛合瑞生物构建的hiPSC源肝脏类器官
三、hiPSC源中脑类器官:帕金森病的治愈新曙光
帕金森病作为常见神经退行性疾病,以大脑多巴胺神经元持续退化为主要特征,传统治疗难以逆转神经损伤。hiPSC源中脑类器官通过特定诱导条件,使hiPSC分化为中脑多巴胺能神经元并构建成功能完整的类器官,不仅形态模拟真实中脑,更具备良好的神经信号传导能力。
盛合瑞生物通过免疫荧光染色鉴定了hiPSC源中脑类器官中多巴胺能神经元的分化情况及多巴胺分泌水平,确保中脑类器官的功能达标。在动物实验中,移植盛合瑞生物hiPSC源中脑类器官的小鼠已展现出显著行为改善,肢体僵硬症状缓解、颤抖频率大幅降低,充分验证了其治疗潜力。结合类器官基因编辑技术纠正致病基因突变,可能实现个性化神经元再生,有望从根源上破解帕金森病治疗难题,为临床应用奠定坚实基础。
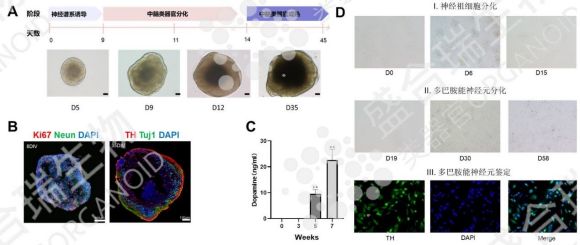
↑ 盛合瑞生物构建的hiPSC中脑类器官
四、hiPSC源脊髓类器官:脊髓损伤修复的新航道
脊髓损伤常导致不可逆的运动与感觉功能障碍,治疗难度极大。hiPSC源脊髓类器官通过精准诱导分化,形成包含脊髓神经元与支持细胞的三维模型,形态与真实脊髓高度相似,且具备良好的神经信号传导能力。
盛合瑞生物采用分步诱导方案构建了hiPSC源脊髓类器官,通过免疫荧光染色明确了hiPSC源脊髓类器官中脊髓神经元分化情况。在动物模型中,移植该类器官的小鼠已实现显著运动功能恢复,证实了其脊髓损伤修复潜力。该模型为脊髓损伤的机制研究、药物研发及细胞替代疗法提供了全新工具,有望改写脊髓损伤治疗的现状。
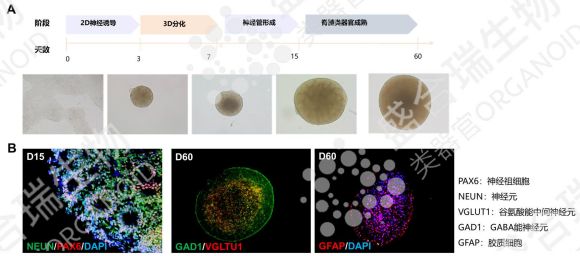
↑ 盛合瑞生物构建的hiPSC源脊髓类器官
五、hiPSC源内耳类器官:听力损失的重建希望
听力损失作为高发感官障碍,严重影响患者生活质量,而hiPSC源内耳类器官的出现为其治疗带来新方向。通过特定诱导条件,hiPSC可分化为内耳毛细胞与支持细胞,内耳类器官不仅形态模拟真实内耳,更具备良好的听觉信号传导能力。动物实验中,移植该类器官的小鼠已实现显著听力恢复,为临床应用提供了有力佐证。
盛合瑞生物通过分步诱导方案构建了hiPSC源内耳类器官,并采用免疫荧光染色鉴定出耳囊阶段祖细胞、毛细胞、听觉神经元等各类细胞组成。未来进一步结合类器官基因编辑技术纠正致病基因突变,可能实现个性化耳蜗毛细胞再生,有望彻底改变听力损失的治疗格局。

↑ 盛合瑞生物构建的hiPSC源内耳类器官
六、hiPSC源心脏类器官:心血管疾病研究的核心平台
心血管疾病作为全球主要死亡原因,其研究与治疗一直面临模型局限。hiPSC源心脏类器官通过诱导分化形成心肌细胞、成纤维细胞与心外膜细胞,构建的三维模型不仅形态模拟真实心脏,更能展现出完整的收缩与舒张功能。
该类器官可高效模拟心肌梗死、心肌病、先天性心脏病等多种疾病模型,通过高通量药物筛选快速评估新药疗效与安全性。
盛合瑞生物成功培养了hiPSC源心脏类器官,通过观察自主搏动现象及免疫荧光染色鉴定细胞组成,确保hiPSC源心脏类器官的功能稳定。hiPSC源心脏类器官有望为心血管疾病的个性化治疗与再生医学研究提供核心支撑。
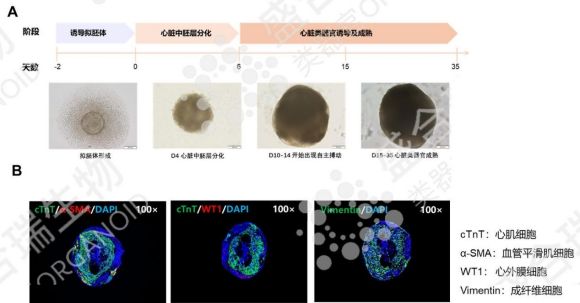
↑ 盛合瑞生物构建的hiPSC源心脏类器官
七、hiPSC源血管类器官:血管疾病研究的精准模型
血管疾病涉及血管狭窄、动脉粥样硬化、血栓形成等复杂病理过程,传统模型难以精准复刻。hiPSC源血管类器官通过诱导分化形成血管内皮细胞与平滑肌细胞,构建的三维模型形态与真实血管高度一致,且具备良好的收缩与舒张功能。
该类器官可有效模拟动脉粥样硬化、血栓形成等疾病场景,为高通量药物筛选提供精准平台。此外,hiPSC源血管类器官还能够用于患者特异性的细胞替代疗法,避免免疫排斥反应。这种个性化治疗方案不仅提高了治疗的安全性和有效性,还为血管再生医学提供了新的方向。
盛合瑞生物通过分步诱导方案构建hiPSC源血管类器官,免疫荧光染色明确了hiPSC源血管类器官的多种细胞组成,包括血管内皮细胞、血管平滑肌细胞以及基底层。在电镜下能够观察到血管的微结构,如紧密连接,确保了模型的真实性与可靠性。该类器官为血管疾病的治疗提供了全新思路与工具。

↑ 盛合瑞生物构建的hiPSC源血管类器官
总结:以技术创新赋能医学未来
iPSC定向分化类器官技术的崛起,正重构疾病研究与治疗的底层逻辑。从疾病模型构建到个性化细胞治疗,从新药筛选到临床转化,这些“迷你器官”已成为再生医学领域的核心力量。从糖尿病到帕金森病,从肝脏疾病到心血管疾病,这些类器官不仅能够用于疾病模型的构建,还能作为细胞替代疗法的候选方案。随着技术的不断创新和临床应用的推进,iPSC源类器官有望成为未来再生医学的主流方案之一。
盛合瑞生物作为专注于类器官研发与服务的高新技术企业,凭借全面的产品体系和成熟技术平台,为科研院所提供iPSC源类器官模型构建及相关产品,助力新药研发企业进行药物筛选与评价。公司以iPSC重编程、类器官培养、类器官基因编辑等核心技术为支撑,努力拓展类器官的应用边界。未来,盛合瑞生物将继续以创新驱动发展,推动iPSC技术走向临床应用,为患者带来治愈希望。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
责任编辑:kj015
蝉联流动性知名大奖!ATFX以实力再证Prime of Prime领导力
原中山一院眼科专家骆荣江教授,在晶亮眼科定期出诊!
著名眼底病、白内障专家周斌兵教授,在晶亮眼科定期出诊!
知名眼科专家吴艺教授,正式在晶亮眼科出诊!
个性化定制近视手术是智商税吗?
名医到身边,冬季护童心!同济大学附属上海第十人民医院谷丽教授坐诊上海六一儿童医院,名额告急
相关新闻
家电推荐
家电图片
新闻排行
- 1
山西广电与阳采集团强强联手“黄河阳采”重塑数字化采购新生态
- 2
iPSC 定向分化类器官:重塑疾病研究与治疗的前沿格局
- 3
盛夏乐鸣温情相聚 意大利Rigo单簧管Rigo-Mamba夏令营全记录!
- 4
海豚公考与领识集团达成战略合作 共推公考培训智能化升级
- 5
2025世界艾滋病日:社会共治,守正创新,多方行动终结艾滋
- 6
凯莱通盐酸替扎尼定片怎么样?看疗效与优势!
- 7
自然交互,高效响应:80+鸿蒙应用智能体全面上线,一句话搞定生活多面
- 8
AI哲学之父吴怀宇:AI新时代人类如何“为自身立命”与“为AI立心”
- 9
从“地瓜经济”到全球布局 浙江中南集团吴建荣分享浙商出海新逻辑
- 10
7岁女孩双眼成功“复位”!天津普瑞眼科马惠芝主任成功为一例大角度继发性内斜视患儿重建双眼视、立体视